Gli aminoacidi delle proteine
L'analisi di un grande numero di proteine ha dimostrato che tutte queste sono composte da 20 aminoacidi “standard”. Questi composti sono noti come α-amminoacidi in quanto, con la sola eccezione della prolina, essi hanno un gruppo amminico primario e un gruppo carbossilico legati allo stesso atomo di carbonio. Tutti gli amminoacidi hanno legato al carbonio α una funzione amminica rappresentata dal gruppo NH2 ed una funzione carbossilica che è rappresentata da gruppo COOH. I singoli amminoacidi, poi, si differenziano l'uno dall'altro dalla catena laterale che è indicata con il gruppo R, che ha struttura, dimensione e carica diverse. Quindi le proprietà chimico-fisiche degli amminoacidi sono dettate da quest'ultimo gruppo. In tutti gli amminoacidi quindi, il carbonio α è un centro chirale, tranne nella glicina in cui il gruppo R è rappresentato da un atomo di idrogeno. Negli organismi viventi le molecole chirali sono di solito presenti in una soltanto delle due forme (R ed L), nel nostro caso, quindi degli amminoacidi, troviamo in natura solo gli isomeri L. L'acidità e la basicità degli amminoacidi sono la conseguenza della contemporanea presenza nelle loro molecole di un carbossile e di un gruppo amminico. Gli amminoacidi hanno un punto di fusione relativamente elevato e possiedono una spiccata solubilità in acqua e una bassa solubilità in solventi organici apolari. Gli amminoacidi, inoltre, esistono come ioni dipolari, anche detti zwitteroni, in cui il gruppo amminico è protonato mentre il carbossile esiste come ione carbossilato. Uno zwitterone può agire sia come acido, quindi essere un donatore di protoni, sia come base, quindi essere un accettore di protone. In altre parole, il gruppo “acido” di un amminoacido è uno ione ammonio e il gruppo “basico” il gruppo carbossilico. Per ciascun amminoacido possiamo scrivere quindi il doppio equilibrio, rappresentato in figura, in cui lo zwitterone potrà dare luogo ad uno ione carico negativamente in soluzione basica ed ad uno ione carico positivamente in soluzione acida. Le sostanze che hanno questa natura sono anfoteliche e vengono spesso chiamate anfoliti.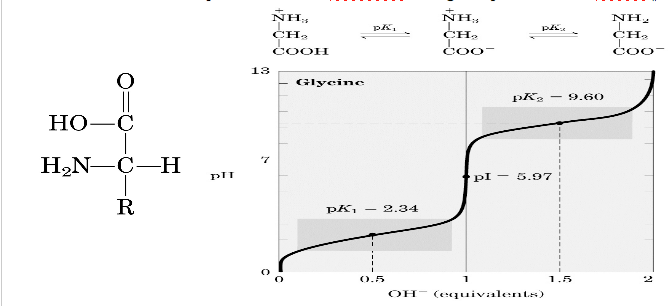
Dall'equazione è evidente che , a valori di pH molto bassi, l'amminoacido esiste in una forma in cui il gruppo amminico e il carbossile sono entrambi protonati: esso porta quindi una carica netta positiva ed è un acido diprotico. A valori elevati di pH, l'amminoacido reca, invece, una carica netta negativa e presente due siti basici ai quali può subire protonazione. A valori di pH intermedi, l'amminoacido esiste prevalentemente come zwitterone che non possiede carica netta. Il valore di pH in cui la concentrazione dello zwitterone è massima è conosciuto come punto isoelettrico, pI, dell'amminoacido. A questo valore di pH, la molecola rimane immobile all'interno di un campo elettrico, cioè non migra né verso il polo positivo né verso quello negativo perché le sue cariche sono esattamente bilanciate. Al contrario a bassi valori di pH, l'amminoacido reca una carica positiva e migra verso il polo negativo, invece, ad alti valori di pH migra verso il polo positivo per la presenza di una carica negativa. Gli α-amminoacidi polimerizzano almeno concettualmente mediante l'eliminazione di una molecola d'acqua. Il risultante legami CO-NH viene chiamato legame peptidico. I polimeri contenenti due, tre, pochi (da tre a dieci) oppure molti residui amminoacidici sono detti rispettivamente dipeptidi, tripeptidi, oligopeptidi oppure polipeptidi. Quest'ultimi hanno masse molecolari molto grandi che possono variare dai 4 ai 440 kD. Comunque i polipeptidi sono polimeri lineari, ossia, ogni residuo amminoacidico si lega a quello vicino con un sistema testa-coda e non si formano catene ramificate, questo sottolinea la semplicità a volte degli organismi viventi che codificano sequenze amminoacidiche lineari partendo da acidi nucleici anch'essi polimeri lineari. In una proteina, i residui amminoacidici con cui termina la catena polipeptidica hanno un gruppo amminico α libero che è il residuo N-terminale, ed il residuo che è all'altra estremità che è un gruppo carbossilico che è un residuo C-terminale. 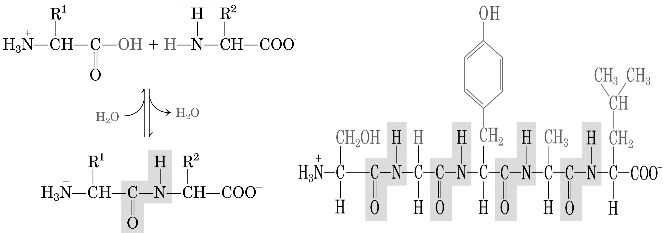
Continua a leggere:
- Successivo: Classificazione e caratteristiche degli aminoacidi
- Precedente: Struttura e funzione delle glicoproteine
Dettagli appunto:
- Autore: Domenico Azarnia Tehran
- Università: Università degli Studi di Roma La Sapienza
- Facoltà: Scienze Matematiche, Fisiche e Naturali
- Corso: Scienze Biologiche
- Esame: Chimica biologica
- Titolo del libro: Biochimica
- Autore del libro: Donald Voet e Judith G. Voet
- Editore: Zanichelli
- Anno pubblicazione: 1993
Altri appunti correlati:
- Fisiologia della nutrizione
- Biologia molecolare
- Biochimica
- Struttura molecolare delle proteine
- Scienze e tecniche dietetiche applicate
Per approfondire questo argomento, consulta le Tesi:
- Crescita di Chlorella vulgaris in acque reflue da vinificazione: studio della cinetica di crescita e del contenuto in lipidi
- Evidenze nutrizionali per il recupero muscolare nell'atleta di endurance
- The role of CARMA2/CARD14 in NF-kB activation signalling
- Caratterizzazione delle specie ittiche di basso valore commerciale del Golfo di Manfredonia
- Approcci Sistemici e Transdisciplinari per la Gestione a lungo termine del Sovrappeso e dell’Obesità
Puoi scaricare gratuitamente questo riassunto in versione integrale.

