Resintesi dei peptidi
FATTORE DI PROTEZIONE

Devono essere lasciati liberi di reagire solo i gruppi amminoacidici (gli altri vanno protetti).
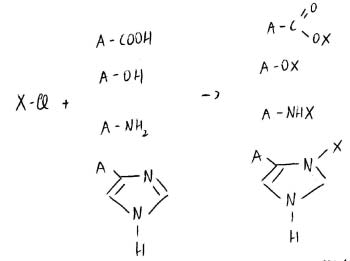
Hanno ΔG di idrolisi molto diversi.
Con un eluente a forza ionica controllata si può rimuovere selettivamente da un solo tipo o da alcuni tipi di gruppi il fattore di protezione.
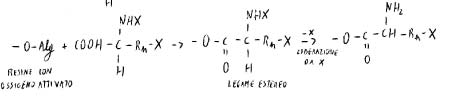
Ci va un solvente a forza ionica tale da rimuovere il fattore di protezione solo dall’α-ammino gruppo e mantenerlo sugli altri.
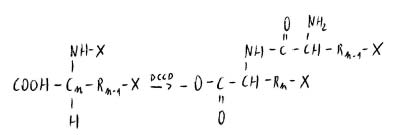
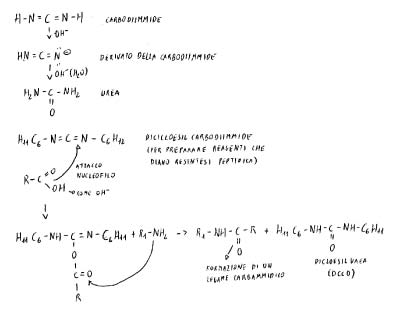
La DCCD estrae H2O tra COOH e NH2 e consente l’attacco nucleofilo. I due peptidi interagiscono: inizio della sintesi del dipeptide.
Si fa un ciclo di lavaggio che elimina il fattore di protezione dall’α-ammino gruppo. Nel ciclo successivo c’è miscela con un amminoacido protetto su COOH: viene assemblato l’amminoacdo n-2 e così via fino all’1.
Si effettua poi un lavaggio a una forza ionica tale da rimuovere X da tutti i gruppi (ripulitura del peptide), con scissione del legame estereo che aggancia il peptide. Il peptide sganciato viene scisso, cristallizzato e confrontato con quello naturale.
In questo modo la naturale sequenza viene dedotta in maniera completa.
Continua a leggere:
- Successivo: Peptidi naturali fini a se stessi
- Precedente: Struttura primaria del peptide o proteina
Puoi scaricare gratuitamente questo appunto in versione integrale.

