Peptidi ciclici
Il C terminale e l’N terminale si chiudono ad anello per condensazione dell’α-ammino gruppo da una parte e 1C dall’altra.
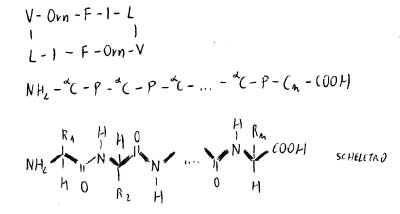
I αC si alternano alla struttura peptidica.
LATTIMICA → LATTAMICA
La trasformazione nell’organizzazione dell’ibridizzazione rende il legame peptidico una struttura rigida. αC tende a stare nella stereoforma a minor ingombro sterico (trans).
Struttura secondaria
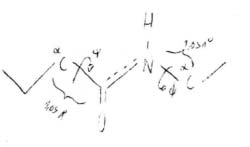
Lunghezze di legame ottenute con misure diffrattometriche.
C’è libera rotazione: fa variare nello spazio le posizioni reciproche degli R (le parti più voluminose).
Si può calcolare un fattore di correzione per ogni R (indici di protuzione).
Cambiano le interazioni con il solvente (aumento con la polarità, se carichi si ha la formazione di aloni di solvatazione estesi).
Costruzione di peptidi artificiali simili a quelli naturali.
Studio della distribuzione di energia funzione di ψ e φ (diagramma di Ramachandran).
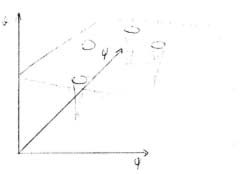
Da misure cristallografiche si ottengono informazioni sulla struttura; da misure sul potenziale si ottiene il potenziale in funzione delle due variabili impostate nel programma di calcolo, cioè la rotazione attorno a αCn/1Cn (φ) e la rotazione attorno a αC/1C (ψ).
Esistono 5 soluzioni che portano a valori minimi di potenziale.
Continua a leggere:
- Successivo: Stereoforme delle strutture secondarie
- Precedente: Peptidi naturali fini a se stessi
Puoi scaricare gratuitamente questo appunto in versione integrale.