Catalisi da legame dello stato di transizione
Alcuni enzimi si legano allo stato di transizione, invece che al substrato, con una maggiore affinità. Le interazioni che legano preferenzialmente lo stato di transizione aumentano la sua concentrazione e proporzionalmente elevano la velocità di reazione. Tutto ciò è spiegabile dal fatto che, il substrato può reagire per formare il prodotto P sia spontaneamente, sia mediante la catalisi enzimatica: 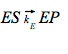
kE e kN rappresentano le costanti di velocità di primo ordine rispettivamente per la reazione catalizzata e per la reazione non catalizzata. Le relazioni tra i vari stadi di queste due reazioni sono riportate in seguito: → →dove: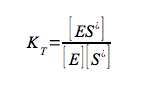
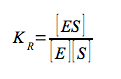
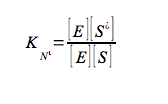
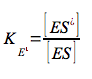
essendo tutte costanti di associazione, di conseguenza: 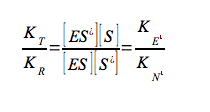
Secondo la teoria dello stato di transizione, la velocità della reazione non catalizzata può essere espressa: 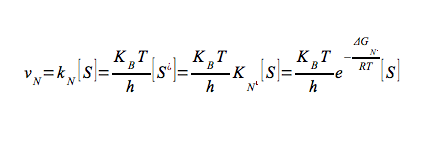
Analogamente la velocità della reazione catalizzata dall'enzima è: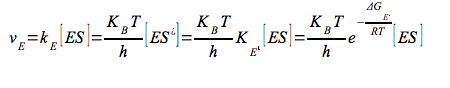
Quindi combinando queste due ultime equazioni avremo che: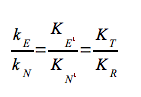
Questa equazione indica che più saldo è il legame di un enzima allo stato di transizione (KT) della reazione, relativamente al substrato (KR), maggiore è la velocità della reazione catalizzata (kE), rispetto a quella della reazione non catalizzata (kN); cioè la catalisi è determinata dal legame preferenziale e dalla stabilizzazione dello stato di transizione (S#). Bisogna ricordare, in conclusione, che se un enzima lega preferenzialmente lo stato di transizione, ci si deve aspettare che analoghi dello stato di transizione, molecole stabili che ricordano strutturalmente S# o uno dei suoi componenti, siano potenti inibitori competitivi dell'enzima. Sono stati caratterizzati centinaia analoghi dello stato di transizione per molte reazioni enzimatiche.
Alcuni di essi sono antibiotici già presenti in natura; altri, invece, sono stati sintetizzati per agire da specifici inibitori enzimatici per scopi terapeutici o per studiare il meccanismo di un particolare enzima.
Continua a leggere:
- Successivo: Il lisozima
- Precedente: Catalisi da effetti di prossimità e orientamento
Dettagli appunto:
- Autore: Domenico Azarnia Tehran
- Università: Università degli Studi di Roma La Sapienza
- Facoltà: Scienze Matematiche, Fisiche e Naturali
- Corso: Scienze Biologiche
- Esame: Chimica biologica
- Titolo del libro: Biochimica
- Autore del libro: Donald Voet e Judith G. Voet
- Editore: Zanichelli
- Anno pubblicazione: 1993
Altri appunti correlati:
- Fisiologia della nutrizione
- Biologia molecolare
- Biochimica
- Struttura molecolare delle proteine
- Scienze e tecniche dietetiche applicate
Per approfondire questo argomento, consulta le Tesi:
- Crescita di Chlorella vulgaris in acque reflue da vinificazione: studio della cinetica di crescita e del contenuto in lipidi
- Evidenze nutrizionali per il recupero muscolare nell'atleta di endurance
- The role of CARMA2/CARD14 in NF-kB activation signalling
- Caratterizzazione delle specie ittiche di basso valore commerciale del Golfo di Manfredonia
- Approcci Sistemici e Transdisciplinari per la Gestione a lungo termine del Sovrappeso e dell’Obesità
Puoi scaricare gratuitamente questo riassunto in versione integrale.

