In particolare i rotavirus sono la causa di infezioni del tratto enterico, sono i principali responsabili di forme di gastroenterite, soprattutto riguardano i bambini. Si conta che nel mondo, soprattutto concentrate nelle zone sottosviluppate, questi virus causino mezzo milione di morti; questo vi fa capire come sia importante trovare farmaci antivirali attivi nei riguardi di questi virus, come diciamo altrettanto è impellente la messa a punto di vaccini in grado di prevenire queste infezioni.
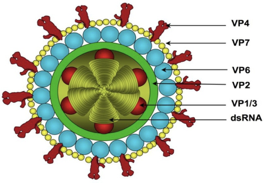
Chi è che arriva a giustificare questo elaborato rivestimento interno presente nei rota? Questo è lo schema di com'è fatta la particella dei rotavirus: abbiamo uno strato esterno, questo giallo, formato dalla proteina VP7, la più abbondante in questo strato esterno.
Sono presenti inoltre... delle spicole che si protrudono verso l'esterno, formate dalla proteina VP4. Abbiamo poi un secondo strato capsidico più interno, formato dalla proteina VP6; sono queste palline colorate in celeste. L'interno più interno ancora, formato da VP2, quindi un terzo strato che racchiude gli 11 segmenti che costituiscono il genoma.
Qualcuno nel frattempo ha pensato perché 3 capsidi? Quasi sicuramente dipende dal fatto che, lo abbiamo sottolineato già diverse volte, il tratto digerente ha dei... i virus, ecco che questo triplice strato proteico protegge i rotavirus, e consente loro di arrivare inalterati nelle cellule ospiti, che sono rappresentate dalle cellule all'apice dei villi intestinali.
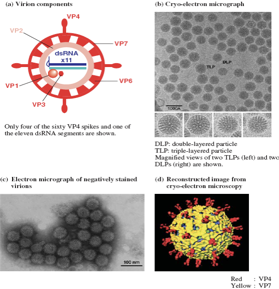
Qui abbiamo una figura più schematica rispetto a quella che abbiamo esaminato, VP7 e VP4 lo strato più esterno, VP6 lo strato intermedio e infine VP2 lo strato più interno denominato comunemente core, che racchiude gli 11 segmenti di RNA bicatenario. Deve essere necessariamente presente un RNA polimerasi RNA dipendente, questa è rappresentata dalla proteina VP1. In associazione con la proteina VP1 deve esserci una seconda proteina che è la VP3. Quindi nel core oltre l'RNA troviamo la proteina VP1 e la VP3, perché la proteina VP3 svolge il ruolo fondamentale di fornire di un cap i messaggeri virali appena sintetizzati.
11 segmenti di RNA. Per una seconda volta, già lo abbiamo esaminato nel virus influenzale, il perché il genoma è suddiviso in tanti segmenti: per presentare al sistema proteino-sintetico della cellula dei messaggeri, letti come monocistronici, che daranno origine a un'unica proteina. Quindi noi diciamo 11 segmenti, 11 proteine. In realtà le proteine non sono 11 ma sono 12, perché un segmento dal momento che ci sono 2 open reading frame (ORF), quindi 2 possibilità di lettura da parte dell'RNA polimerasi, il nostro segmento non da origine ad un'unica proteina ma da origine a 2.
Quindi complessivamente 12 proteine, di queste 12, 6 sono proteine strutturali e invece 6 sono proteine non strutturali. Le proteine strutturali sono indicate con la sigla VP che significa proteina virale. Mentre quelle non strutturali sono indicate con la sigla NS.
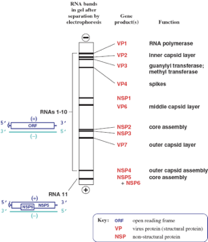
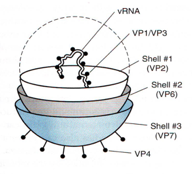
Le proteine strutturali sono la VP1, VP2, VP3. La VP1 è la RNA polimerasi, mentre la VP3 prende contatti per formare il cap nel 5' degli RNA messaggeri. La VP2 forma il core, abbiamo la VP4 che forma le spicole (colorate in rosso) che si proiettano verso l'ambiente extracellulare. Abbiamo poi la VP6 (colorate in celeste) che forma l'involucro intermedio. Ed infine la VP7 che è localizzata alla superficie, e vedremmo che è implicata nel processo di ancoraggio del virus alla cellula ospite come pure molto probabilmente partecipa alla liberazione del core virale una volta che è avvenuta endocitosi.
Le altre 6 siglate NS ossia proteine non strutturali svolgono un ruolo fondamentale nel partecipare all'assemblaggio delle particelle di rotavirus, e di alcune … oggi è definito il ruolo svolto durante il ciclo di replicazione. Per esempio la proteina non strutturale NSP3 oltre che partecipare all'assemblaggio del core è la proteina che probabilmente consente al virus di prendere il sopravvento sulla sintesi macromolecolare della cellula per avvantaggiare la trascrizione e la traduzione dei messaggeri virali.
Il ciclo replicativo dei rotavirus
Qual è l'ospite prediletto dai rotavirus? Le cellule infettate sono le cellule dell'apice del villo, dove i rotavirus riescono a realizzare l'absorbimento al quale segue la penetrazione all'interno della cellula. Perché proprio le cellule all'apice e non quelle che sono alla base del villo? Le cellule all'apice di un villo sono le cellule più differenziate, sono normalmente chiamate mature e quindi diciamo che c'è un ambiente particolarmente idoneo e rispondente a quelle che sono le esigenze dei rotavirus per realizzare la loro replicazione.
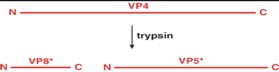
Succede qualcosa di veramente peculiare. Si proiettano dalla superficie del virus delle spicole e queste spicole sono formate dalla proteina strutturale VP4. Questa proteina che è l’ antirecettore virale ossia il recettore che riconosce l’antirecettore che riconosce il recettore presente nel villo, deve essere attiva, deve essere clivata in 2 frammenti, che sono VP8 e VP5. Chi è che realizza questo clivaggio della proteina virale? Viene realizzato da un’attività enzimatica presente nell’intestino quindi un enzima cellulare. Qual è il paradosso? Il paradosso è che la tripsina viene considerata un’attività enzimatica di difesa; qual è il ruolo fisiologico delle tripsina?? Arriva il cibo, ecco che i peptidi dalla tripsina presente nei vari..., vengono frantumati per facilitare la loro digestione e il loro utilizzo. Le cose vengono sovvertite; un enzima che normalmente è una barriera di difesa, diventa un’attività enzimatica indispensabile perché si abbia l’avvio del processo infettivo; è indispensabile perché VP4 per potersi ancorare e (poi vedremmo successivamente) andare avanti in un processo di endocitosi deve essere clivata in VP8 e VP5. Il VP5 è riconosciuto, come dire ha una porzione idrofobica che invece è nascosta in VP4, e probabilmente questa porzione idrofobica giustifica una delle due modalità (possibilità). Giustifica il fatto che si crei una porzione idrofobica nella proteina VP5, giustifica una delle 2 possibilità che sono ancora discusse circa la modalità con la quale i rotavirus entrano nelle cellule.
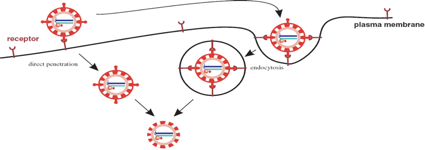
È chiamata in causa sia una penetrazione diretta, il virus si ancora sul recettore, probabilmente la porzione idrofobica del VP8 determina scompaginamento a livello della membrana citoplasmatica; c'è addirittura di chi parla della formazione di un foro attraverso il quale la particella virale può penetrare. In alternativa, molti sono i fautori di questa seconda possibilità: il virus si ancora e penetra nella cellula non direttamente attraverso un foro nella membrana citoplasmatica, ma attraverso un processo di endocitosi. Si ha ancoraggio. Probabilmente è un virus che richiede l'interazione con più recettori presenti nella cellula; però non sappiamo con quali, sono chiamate in causa integrine, è chiamato in causa l'acido sialico, però non lo sappiamo. Probabilmente oltre l'interazione del VP4 c'è l'interazione anche da parte dell'altra proteina dell'involucro più superficiale che è la proteina VP7. Una volta che è penetrato, in quanto c'è stata una introflessione della membrana citoplasmatica, che poi si distacca liberando l'endocita nel citoplasma. A questo punto il virus si è rivestito di un ulteriore involucro, necessariamente deve continuare a spogliarsi per poter arrivare alla sua espressione.
Qui c'è un'ipotesi suffragata da molti dati sperimentali, anche se però non è definitivamente comprovata. Che cos'è nell'endocitosi, che abbiamo visto fino ad adesso, che determinava la fuoriuscita delle particella virale nel citoplasma? L'acidità, il cambiamento di pH. Ad un virus come il rotavirus gli conviene essere sensibile nella sua compattezza strutturale ad un pH basso? No. Perché? Deve passare dallo stomaco. Per quanto riguarda gli adenovirus esiste ancora il... problema, abbiamo visto la volta scorsa raggiungono i sierotipi 40 e 41..., e poi una volta che sono entrati per endocitosi è il basso pH che scompagina la membrana dell'endosoma e il virus si libera. Non c'è risposta. Perché non c'è scompaginato nel pH basso dello stomaco? C'è una spiegazione, ed è proprio questa ipotesi che viene fatta per i rotavirus, è prevista a pH acido e quindi si giustifica il loro passaggio attraverso lo stomaco, mentre la liberazione, il procedere nel processo di uncoating all'interno dell'endosoma è mediato dalla concentrazione di ioni calcio.
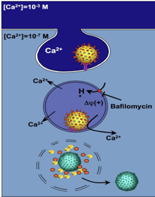
Quando si forma la vescicola di endocitosi, la concentrazione di calcio all'interno di questa vescicola sarà uguale a quella dell'ambiente esterno. La membrana citoplasmatica si introflette, cattura una porzione di tutto ciò che c'è in ambiente extracellulare, si porta così dietro la particella virale. Quindi una concentrazione di calcio che è calcolata intorno a 1 millimolare, quindi molto più alta di quella concentrazione di calcio che caratterizza l'ambiente intracellulare. Si crea un gradiente, una volta che si è completato il processo di endocitosi, che porta il calcio dall'interno della vescicola di endocitosi in ambiente extracellulare. Un'ulteriore spinta a questa fuoriuscita di calcio avviene perché sappiamo che nella membrana dell'endocita c'è una pompa che tira dentro idrogenioni.
Abbiamo visto bene il processo di uncoating del virus dell'influenza. Quindi altre cariche positive, ulteriore spinta di ioni calcio caricati positivamente in ambiente extracellulare. Le cose vanno avanti con il progredire della diminuzione degli ioni calcio all'interno della vescicola di endocitosi si ritiene che arrivati a un certo livello di calcio ci sia scompaginazione, mostrato bene in questo schema; si ha scompaginazione delle 2 proteine VP4 e VP7 dello strato più esterno dei rotavirus e il genoma virale rimane racchiuso a questo punto in 2 involucri proteici (quello intermedio e il core). A questo punto si ritiene che proprio la proteina VP5, che era quella derivata dal clivaggio di VP4 in seguito all'azione della tripsina, caratterizzata da una porzione idrofobica, possa creare dei fori nella membrana dell'endosoma e così … e finalmente siamo arrivati a liberare il core, lo strato intermedio, il genoma quindi la particella parzialmente svestita nel citoplasma.
“Hypothetical model of rotavirus entry by endocytosis. After rotavirus particles bind to receptors on the cell surface, they are endocytosed into vesicles together with extracellular fluid containing Ca2+ in the 1 mM range. Once inside the endocytic vesicle, Ca2+ is transported into the cytoplasm driven by the large concentration gradient (from 1 to 100 nM). The exposition of VP5 may form a pore and permit Ca2+ flux into the cytoplasm. The electrical gradient (positive inside) generated by the v-type H+ pump provides an additional force for Ca2+ extrusion out of the endosome. Once Ca2+ has dropped to a critical concentration, the virus uncoats and the external solubilized proteins, VP5* and perhaps VP7, permeabilize and lyse the endosomal membrane. In this way, the DLP gains access to the cytoplasm and replication is activated”.
Domanda: Non ho capito bene la concentrazione di calcio nelle varie fasi.
Risposta: Abbiamo che all'inizio la concentrazione di calcio è molto alta, pari a quella in ambiente extracellulare; una volta che la vescicola si distaccata, è chiusa completamente, c'è un notevole salto di concentrazione, pare sia quella extracellulare ma non sono sicura, siamo comunque nell'ordine del nanomolare. Quindi si crea un gradiente che porta le cariche positive da dove sono più concentrate, dentro l'endosoma, in ambiente extracellulare. In tutto questo la fuoriuscita di cariche positive è incrementata dall'ingresso di idrogenioni all'interno del'endosoma; in seguito a questo influsso di calcio, la concentrazione di calcio si abbassa sino ad arrivare ad un punto che scompagina l'involucro più superficiale nella particella di rotavirus e arrivati a questo punto siamo ad una parziale svestimento delle particelle virali che così parzialmente svestite arrivano nel citoplasma.
A questo punto succede ancora qualcosa di curioso. Degli altri esempi che avevamo visto il capside rimaneva integro o veniva disintegrato nell'uncoating? non completamente perché qualche proteina rimane in contatto con i genomi, perché nella cellula ci sono le nucleasi. Qui la curiosità è che il virus non si svestirà mai durante il proprio ciclo replicativo; comincia ad esprimersi ancora avvolto da un doppio strato di proteine. Lo strato più interno core (in tutte le successive diapositive è colorato in rosa) e lo strato più esterno formato dalla proteine VP6.
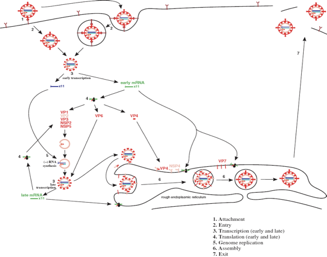
C'è un altro problema. È un virus che ha un RNA polimerasi, sappiamo benissimo che c'è una catena meno (-) che può essere copiata in più (+).
Ma come fanno questi messaggeri ad uscire? Come fanno i precursori indispensabili al virus a sintetizzare questi RNA virali? Il tutto è possibile perché questi strati sono attraversati da canali che consentono sia l'ingresso dei precursori ribonucleotidi trifostati, sia, una volta che questi precursori sono stati utilizzati per sintetizzare l'RNA virale, affinché questi RNA messaggeri neotrascritti possano fuoriuscire dalla particella virale per andare nel citoplasma ed essere tradotti.
Quindi peculiarità: non un totale svestimento, il virus rimane coperto da addirittura 2 strati, i quali sono attraversati da canali che consentono il flusso dei messaggeri e l'ingresso dei precursori affinché i messaggeri possano essere sintetizzati.
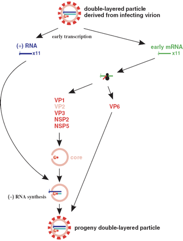
Siamo arrivati al punto in cui l'RNA polimerasi che il virus si porta dietro, può sintetizzare gli RNA messaggeri. Questi RNA messaggeri neo sintetizzati hanno grazie all'intervento della proteina VP3 un cap, ma sono sprovvisti, contrariamente al messaggero cellulare, di una coda di poli A. Alcune proteine strutturali VP1, VP3 e VP6 vengono sintetizzate in polisomi, cioè la sintesi di queste proteine avviene a livello di ribosomi liberi nel citoplasma. Altre proteine virali che sono quelle che andranno a formare lo strato più superficiale, vengono sintetizzate nel reticolo endoplasmatico. Le proteine che partecipano alla formazione del core insieme alle proteine VP1 e VP3 che sono l'RNA polimerasi e la proteina che fornisce il messaggero del cap, si appartano in zone del citoplasma chiamate viroplasma; cosa fa a questo stadio del ciclo replicativo la proteina VP2? Forma il core ed è associata anche all'RNA polimerasi VP1 e alla VP3 che servirà a dotare i messaggeri di cap. Perché si possa formare questo intermedio replicativo è necessaria la partecipazione di 2 proteine non strutturali che sono la NSP2 e NSP5. Si è formato un core, le altre attività enzimatiche sono entrambi presenti. Ecco che sono 11 i messaggeri trascritti in questa particella. Utilizzando l'RNA polimerasi RNA dipendente, man mano che un messaggero entra verrà copiato per riformare l'originale genoma formato da un RNA bicatenario.
Riepilogo: siamo arrivati alla possibilità di sintetizzare messaggeri; verranno formati 11 messaggeri differenti perché 11 sono i segmenti, anzi saranno 12 perché uno dei segmenti codifica per 2 proteine e il ruolo di questi messaggeri sarà quello di prendere contatto con i ribosomi per sintetizzare le proteine virali. Ma ovviamente questi messaggeri devono fungere da stampo per la formazione di nuovi genomi. Dove avviene questo? Avviene nel viroplasma. Nel viroplasma le proteine VP2 si sono assemblate a formare un core; sono associate con l'RNA polimerasi RNA dipendente e con la VP3. Ecco che gli 11 segmenti di RNA (+) possono prendere e arrivare nel viroplasma, entrare nel core neosintetizzato e man mano che entrano vengono copiati dall'RNA polimerasi RNA dipendente, torneranno ad essere RNA bicatenario. Questo avviene per tutti gli 11 segmenti e quindi torneremmo ad avere, dopo che si è unita anche la proteina VP6, una particella di progenie simile a quella da cui tutto era partito.
Siamo arrivati alla formazione di una particella di una progenie, di una particella con 2 strati proteici che è molto simile a quella originaria dalla quale è partito il tutto. Che cosa ci manca ancora? Ci chiediamo come fa il virus a prendere il sopravvento sulle sintesi macromolecolari della cellula ospite. Anche qui siamo a livelli non ancora molto sicuri, però vi dicevo che una caratteristica dei messaggeri dei rota è quella di non avere una coda di poli A. C'è però una particolarità, la proteina NSP3 è in grado, comportandosi come un'omologa proteina cellulare, di legarsi all'estremità 3' dei messaggeri e questo si ritiene che sia un ruolo molto importante svolto dalla proteina non strutturale, che è in qualche modo il facilitare il processo di traduzione dei messaggeri virali.
Un altro ruolo svolto dalla proteina NSP3 è quello di interagire con un fattore di inizio della sintesi proteica, i messaggeri virali restano tradotti preferibilmente rispetto ai messaggeri cellulari. Qui chiamiamo in causa questa proteina non strutturale sia per giustificare come possono essere tradotti i messaggeri privi di una coda di poli A come quelli dei rota, sia diciamo sono proteine in grado di interagire con un fattore di inizio della sintesi proteica cellulare; la mancanza di questo fattore fa si, non sappiamo ancora in quale maniera, che i messaggeri virali vengano tradotti, mentre è impedita allo stesso tempo la traduzione dei messaggeri cellulari.
“Rotavirus mRNAs lack a poly(A) tail, but have instead a consensus sequence at their 3' ends that binds NSP3, acting as a functional homologue of poly(A)-binding protein (PABP). NSP3 also interacts with the cell-initiation factor eIF4GI. It is widely believed that these interactions lead to the translation of rotaviral mRNAs, impairing at the same time the translation of cellular mRNAs”
Siamo arrivati a questo punto del ciclo replicativo: sono stati copiati gli 11 segmenti e sono stati racchiusi in un doppio strato proteico, il core e quello più esterno formato dalla proteina VP6. Affinché da questa cellula si possano liberare particelle virali, complete e infettanti dobbiamo ancora sintetizzare lo strato più esterno, più superficiale formato da VP4 e VP7. Come vanno le cose? Mentre i messaggeri, le proteine (che sono stati utilizzati in questo momento del ciclo replicativo) sono state sintetizzate in ribosomi liberi nel citoplasma, le proteine di questo involucro più esterno, come pure alcune proteine non strutturali vengono sintetizzate a livello del reticolo endoplasmatico rugoso. La proteina VP7, la proteina NSP4 una volta sintetizzate a questo livello vengono inserite nelle membrane del reticolo endoplasmatico. Come va avanti questo processo di formazione della particella virale completa? È importante a questo punto il ruolo svolto dalla proteina NSP4. Questa proteina NSP4 ha la possibilità di interagire sia con una proteina VP4 (proteina che formerà le spicole), sia in un altro sito è in grado di attaccarsi alla particella intermedia caratterizzata da un doppio strato.
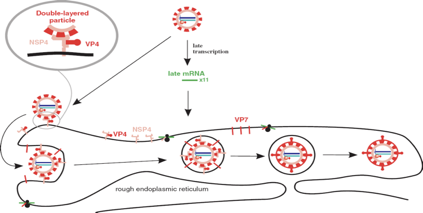
Ricapitolando: alcune proteine strutturali come la VP7 e non strutturali come la NSP4 vengono sintetizzate nel reticolo endoplasmatico rugoso dove rimangono ancorate nella membrana di queste strutture. Di particolare importanza è, nel progredire del processo di morfogenesi, il ruolo svolto dalla proteina NSP4. Ha come dire due braccia: da una parte lega le VP4 (le future spicole), dall'altra lega la particella in via di formazione che a questo punto è caratterizzata da 2 involucri proteici. Nella figura: la NSP4 che ha legato la VP4 e una particella in via di formazione.
A questo punto questa particella penetra, viene ingerita a livello del reticolo endoplasmatico e di conseguenza viene ad acquisire un ulteriore involucro. Ricordatevi che stiamo esaminando un virus privo di capside. Questo involucro è una struttura superficiale temporanea. A questo punto la proteina VP7 che era presente nella membrana (barrette rosse nella figura), si troverà ora alla superficie di questa vescicola. La proteina VP7 viene clivata e servirà a formare insieme alla VP4 lo strato più esterno che caratterizza una particella virale completa. Non si sa ovviamente con quale meccanismo queste particelle, ovviamente devono perdere questa membrana più esterna per arrivare alla formazione di un virus nudo completo ed infettante. È il virus il cui ciclo replicativo comporta alla fine la morte della cellula. La cellula muore, perde la sua integrità e probabilmente in questo modo le particelle di rotavirus neo formate sono riversate in ambiente extracellulare.
Questa diapositiva è una diapositiva piuttosto aggiornata. Ci sono punti interrogativi, perché vi dicevo all'inizio ancora molti aspetti del ciclo replicativo di qualsiasi... virus, di tante proteine non strutturali non è ancora chiaro. Però mi è sembrato utile inserirla, perché diciamo ricapitola tutto quello che fino ad adesso abbiamo detto. Partiamo da particelle caratterizzate da un primo strato proteico, vi dicevo prima che non sappiamo chi sono i recettori presenti nella cellula ospite, ne sono stati chiamati molti in causa come per esempio l'acido sialico, abbiamo già visto il recettore utilizzato da chi? dal virus dell'influenza e si ritiene che non soltanto la VP4 medi il contatto con la cellula ospite ma intervenga anche la proteina VP7.
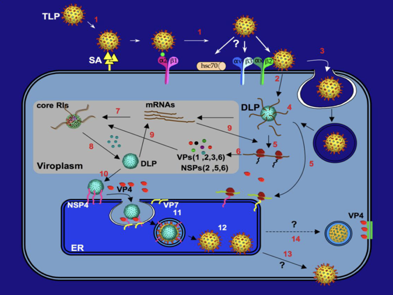
Una prima modalità di ingresso nella cellula chiama in causa un passaggio diretto attraverso pori, presunti pori formati nella membrana citoplasmatica. Altre linee di ricerca indicano invece il processo di endocitosi come modalità utilizzata da questo virus per penetrare all'interno della cellula ospite.
Come poi fuoriuscire una volta catturato all'interno della vescicola di endo (dice anche fagocitosi)? Chiamiamo in causa il calcio. All'inizio all'interno della particella fagocitata, la concentrazione di calcio è elevata e corrisponde a quella dell'ambiente extracellulare; man mano che (avviene) il flusso di ioni calcio, questa concentrazione scende, c'è uno scompaginamento nella struttura proteica più superficiale nel virus ed ecco che rimangono i 2 strati, core e lo strato intermedio costituito dalla proteina VP6.
A questo punto cosa succede? In questa struttura sono presenti come dei canali che consentono ai precursori, indispensabili per la sintesi degli RNA messaggeri, di entrare all'interno del core. Verranno sintetizzati, perché c'è una RNA polimerasi RNA dipendente, messaggeri virali specifici e sempre attraverso canali (li vedete qua)... escono e si portano nel citoplasma. Siamo arrivati al punto numero 5. Alcuni di questi messaggeri vengono tradotti in polisomi ossia ribosomi liberi, mentre altri messaggeri verranno tradotti in proteine nelle membrane del reticolo endoplasmatico rugoso. Le proteine che sono state sintetizzate in polisomi si accumulano in zone del citoplasma che sono chiamate viroplasma ed ecco che si ha dapprima l'assemblaggio di un core, formato dalla proteina VP2. In questo core penetrano gli RNA messaggeri che fungono da stampo per la formazione di nuovi genomi. Non vi ho detto, c'è questa proteina del core in fase di montaggio che si è legata anche all'RNA polimerasi RNA dipendente. Quindi come arriva un segmento (+) che deve fungere da stampo come penetra all'interno del core viene copiato dalla polimerasi nella catena complementare (-) e così si ristabilisce l'originario genoma formato da 11 pezzi di RNA bicatenario. Una risposta molto bella da avere in futuro è: come fa questo virus a capire esattamente quali sono gli 11 segmenti che devono essere incapsidati per far si che la progenie arrivi ad avere un'informazione genetica identica a quella del virus originario? Non c'è una risposta. Ci sono molti studi a riguardo. Si hanno anche nel caso dell'influenza. Però per quanto riguarda la morfogenesi del virus dell'influenza siamo molto più avanti rispetto alle nozioni che sono state ottenute dei rotavirus. Quello che sappiamo che in ogni sequenza di ciascun segmento di RNA è stata individuata una particolare sequenza responsabile dell'impacchettamento di quel segmento. Però perché proprio quegli 11? Non è che se apriamo la particella di rota troviamo tanto per dire più tutti di un segmento, ma ne troviamo 11 e sempre gli stessi 11. Non si è ancora scoperto come il virus realizzi questa tappa del suo processo morfogenetico.
Siamo arrivati a questo punto. Siamo arrivati, siamo entrati, siamo stati copiati, abbiamo un genoma; la proteina VP6 si aggiunge all'esterno della proteina VP2 del core e si forma una particella cha ha una doppio strato. Nel frattempo però alcuni messaggeri sono andati come vi dicevo ad essere tradotti in ribosomi associati a reticolo endoplasmatico e viene ad essere sintetizzata la proteina VP7. Un'altra proteina importante, sempre in questa localizzazione cellulare è la
proteina non strutturale NSP4. Questa proteina da un lato acchiappa la particella con doppio strato e dall'altra parte invece lega la proteina VP4 le future spicole. Il tutto viene ingerito all'interno del reticolo endoplasmatico e automaticamente si porterà dietro le proteine VP7 che sono state inserite nella membrana. La VP7 presente alla superficie di questa vescicola viene poi clivata, si distacca dalla membrana per partecipare con la VP4 a formare lo strato più esterno che caratterizza questi virus con un ciclo veramente peculiare. Questa è un'ipotesi accreditata, vi ho già detto che non sappiamo gli ultimi passi che portano alla fuoriuscita delle particelle virali in ambiente extracellulare, secondo altri studi la VP4 non sarebbe inserita a livello del reticolo endoplasmatico, ma la particella virale immatura acquisterebbe le spicole nella fuoriuscita per gemmazione della cellula dove le VP4 sono state localizzate.
Come si diffondono da un individuo ad un altro?
La strada più adatta è sicuramente il circuito oro-fecale.
Rotavirus remains infectious suspended in water, so the virus can be spread in a contaminated water supply. Because as few as ten rotavirus particles can initiate an infection, it's easy to understand how this virus spread so efficiently by the fecal-oral route.
È soltanto a livello intestinale che trovano tripsina, abbiamo detto come questa attività enzimatica è indispensabile affinché possa avvenire l'absorbimento. La proteina VP4 deve essere infatti clivata in VP5 e VP8 per poter prima procedere all'ancoraggio e poi anche partecipare all'uncoating una volta che la particella è penetrata per endocitosi. Vi ho anche già detto che le cellule che predilige sono le cellule all'apice dei villi. Quando una persona è infettata basta anche non una infezione di molte cellule intestinali, si hanno delle forme diarroiche veramente drammatiche che nei paesi sviluppati possono essere controbilanciate idratando il soggetto colpito, somministrando acqua, zuccheri e Sali. Però non c'è questa possibilità nei paesi sottosviluppati, oltretutto colpisce bambini già di per sé denutriti e purtroppo questa infezione apparentemente banale, che in realtà banale non è, causa un numero elevatissimo di decessi. Poche cellule intestinali sono accompagnate dall'emissione di un numero enorme di particelle virali nelle feci. Eliminate nelle feci contaminano l'ambiente. È un virus che in ambiente acquoso sopravvive molto bene, questo capite bene che apre facilmente la porta alla sua diffusione nel circuito oro fecale. Una cosa importante è che ne elimina tantissime, però è anche vero che questo virus è talmente robusto nella sua costituzione, che bastano pochi virus, una decina di virus per innescare un processo infettivo. È questa ovviamente è un'altra cosa che amplifica in maniera enorme la sua possibilità di diffusione. Questo virus ha scelto non un solo vestito di proteine ma ben 3, uno dopo l'altro. Abbiamo detto che dal punto di vista evolutivo che cosa ha comportato? La risposta più ovvia è: perché così riesce ad oltrepassare tutte le difese che trova a livello dell'intestino. Ma avere un rivestimento così complesso (non comporta solo questo). Uno dice sono virus che hanno un genoma a RNA bicatenario, che cosa vi fa venir in mente questo? L'interferon. Non sono tra gli induttori di interferon e il motivo è semplice. Quando è che nella cellula si vengono a formare particelle di RNA bicatenario? All'inizio quando finisce l'uncoating, però questo RNA bicatenario rimane coperto da due involucri proteici. Quand'è che ritroveremmo nella cellula RNA bicatenario? Quando è avvenuta la sintesi di messaggeri, proteine, si forma un core ed ecco che gli RNA (+) a singola catena, come vengono convertiti in forma doppia? Man mano che entrano nel core. Possiamo dire che è un virus che replica sempre sotto copertura. Non c'è un momento in cui RNA bicatenario è libero nel citoplasma. Il fatto di essere sempre vestito nasconde l'RNA bicatenario da tutti i sistemi cellulari atti a fiutare qualcosa di estraneo ed ecco che di conseguenza i rotavirus usano questa strategia per evadere la condizione di interferon e avere così la possibilità di allertare le cellule vicine della possibilità che stanno per essere infettate da un rotavirus. C'è da dire che il nostro sistema immunitario si “lascia fregare” per quanto riguarda l'interferon, però ha a disposizione molte altre armi della difesa innata, macrofagi, complemento ed ecco che è un virus che può essere facilmente controllato dal nostro sistema immunitario.
La risposta immunitaria ai rotavirus
Però normalmente la replicazione virale aumenta, vi ho detto che è un virus che porta alla lisi della cellula ospite, dire accumulo di detriti cellulari, in seguito della replicazione virale, vuol dire anche macrofagi che mangiano molto, vuol dire anche macrofagi che sfruttano citochine, vuol dire anche che si crea una situazione che allerta il sistema immunitario di tipo adattativo. Ed ecco che al seguito del funzionamento della risposta adattativa si vengono a formare IgA specifiche nei riguardi dei rotavirus che velocemente portano all'eliminazione del virus dall'intestino. Ma quanto tempo ci è voluto per la produzione di questo IgA? Circa una settimana. Ed ecco che il virus in quella settimana (ha un ciclo abbastanza veloce) ha avuto tutto il tempo di formare un numero enorme di nuove particelle da eliminare con le feci. Si dice che è un virus hit and run cioè colpisce e scappa. Quando abbiamo una risposta immunitaria adattativa con la produzione di IgA umorali, al virus non gli importa più nulla, perché lui il suo scopo di replicarsi, di fuoriuscire dall'organismo che è stato infettato, per avere la possibilità di andare ad infettare altri individui, l'ha già realizzato. Ancora una volta affida la propria replicazione all'RNA polimerasi RNA dipendente, è un enzima che compie un sacco di errori e quindi ovviamente il processo replicativo dei rota è accompagnato da antigenic drift ossia da una deriva antigenica; come vi dicevo all'inizio sono sette i sierotipi di rotavirus attualmente conosciuti, con un sierotipo A che è quello più frequentemente isolato.
1) Rotavirus “replication under cover” strategy helps it evade the host's interferon defense, buying time for the virus to reproduce and spread.
2) Rotavirus is a “hit and ran” virus
3) Antigenic drift; seven different groups of rotavirus 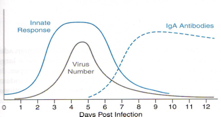
Qual è la conseguenza dell'infezione?
Ovviamente vengono danneggiati i villi intestinali, possiamo dire per capirci bene, visto che sono quelli agli apici questi enterociti vengono come dire capitozzati e qual è la funzione di questi villi? Le cellule che stanno alla base sono quelle responsabili di eliminazione di acqua, mentre quelli che stanno all'apice dei villi sono quelli che riassorbono. Si riteneva che proprio questo danneggiamento dell'enterocita fosse la causa di squilibri e quindi di conseguenza diarrea. Le cellule che erano responsabili del riassorbimento dell'acqua sono danneggiate, l'acqua non viene riassorbita e di conseguenza avremmo l'eliminazione di grosse quantità di feci liquide.
Oggi diciamo che questa teoria non è ritenuta valida, cioè molto probabile che non lo sia, perché sono alle volte poche le cellule danneggiate. Quindi il fenomeno patologico e quindi l'enorme produzione di diarrea non è giustificato da un piccolo danno.
Oggi si ritiene che tutti i sintomi legati alla gastroenterite provocata dagli enterovirus, sintomi che sono febbre, vomito e diarrea sono mediati dal sistema nervoso centrale. Quindi una stimolazione che dal luogo di infezione viene trasportata al cervello e dal cervello abbiamo una risposta in grado di evocare questi sintomi. Non sappiamo la funzione di tante proteine, però negli ultimi anni molti dati riportati cominciano a far luce anche su questo virus responsabile di queste infezioni con esiti spesso drammatici.
Come contare le particelle dei virus
Avete mai visto delle cellule infettate da virus che producono placche? Quando noi in laboratorio vogliamo coltivare un virus; quello che voglio spiegarvi adesso è come è possibile contare le particelle dei virus. La risposta immediata che voi dovete dare, se io vi do un campione e vi dico “qui ci sono particelle virali, voglio sapere quante ce ne sono?” cosa vi serve? Ci basta uno strumento che conta. Il microscopio elettronico. Giusto. Ma lasciamo perdere il microscopio elettronico, perché per usare il microscopio elettronico ce ne vuole parecchio; ce ne sono ancora molto pochi per il costo elevato. Comunque uno con un microscopio elettronico... stiamo parlando di microrganismi dell'ordine del nanometro, non arriveremmo mai a vedere … tutta la vita. Quando lei usa il microscopio elettronico ovviamente lei conta sia le particelle complete virali ed infettanti sia quelle defettive. Quando un virus libera una progenie ovviamente ci sono molte particelle fatte per bene, cosa vuol dire complete ed infettanti? Complete strutturalmente che hanno la capacità di prendere rapporto con un'altra cellula e di dare avvio ad un altro ciclo replicativo. Però insieme a queste particelle infettanti ci sono molte particelle defettive, se le guardi al microscopio non distingui le infettanti dalle non infettanti che possono essere strutturalmente identiche. Per usare il microscopio elettronico bisogna essere molto bravi e poi bisogna avere il microscopio elettronico (costa una barca di soldi), si deve avere la possibilità di mantenerlo, saperlo usare.
Come noi possiamo quantificare il numero di virus? In una provetta quanti virus ci sono? Possiamo farlo andando a misurare le unità formanti placca .
Come possiamo fare? questo è il risultato, cosa vi servirà questa volta come punto di partenza? Ho una provetta con del virus, prima di tutto servono delle cellule. Non il terreno, si possono avere tutti i terreni a disposizione che ti offrono le ditte farmaceutiche del mondo, ma non riusciremmo mai a far crescere quel virus. La prima cosa che mi serve è una piastra, prendiamo un virus animale oppure un virus batterico, uno non soltanto devo avere una cellula, ma devo avere delle cellule che abbiano per prima cosa? Se io voglio titolare una... con T4, cosa vi serve? E.coli. Se io ho a disposizione un batterio che non ha recettori per quel virus, d'accordo? Io ho lavorato con il poliovirus, mi servono le cellule... Ho lavorato anche con l'HIV mi servono le cellule che abbiano il recettore CD4. Voglio lavorare con il virus dell'epatite C mi servono le cellule che abbiano quel determinato recettore per il virus dell'epatite C. Ed è sempre ristretto l'ambito, le cellule a disposizione. Parlo adesso di un monostrato generico di cellule. Di queste piastrine qua io ne ho 3, sto semplificando il tutto. Questo è il mio monostrato, e questo è il mio monostrato. Io ho una provetta; l'incognita è: io voglio determinare quante particelle virali sono presenti in questo stock virale. Cosa faccio? Faccio 3 diluizioni. 1 a 10, 1 a 100 e 1 a 1000. Rispetto a questa provetta qui ci sarà 10 volte meno virus, qui ci sarà 100 volte meno virus e qui ci sarà 1000 volte meno virus. Queste cellule le ho preparate facendole aderire ad una piastra, al momento dell'infezione le ho guardate al microscopio e sono un bel pavimentino di cellule belle attaccate e sono ricoperte dal terreno che fornisce tutti gli alimenti che servono a queste cellule per dividersi fino a formare un monostrato. La prima cosa che devo fare è infettare. Prendo questa piastra Petri che contiene delle cellule, togliamo via il liquido aspirandolo e poi metto 1 mL di questa diluizione, metto qua un mL della diluizione 1 a 100 e qui deposito 1 mL della diluizione maggiore 1 a 1000. Lascio che il virus si adsorba, si lascia un'ora affinché il virus si possa attaccare. Rimuovo... e ricopro con il terreno di coltura. Questa volta però il terreno di coltura deve avere una caratteristica, deve essere un terreno semisolido. Quindi utilizzo un terreno alla quale ho aggiunto per esempio dell'agarosio, del carbossido di cellulosa per renderlo più solido. Perché devo rendere il terreno semisolido? Dobbiamo aprire una parentesi, questo è il monostrato di cellule, io infetto, una cellula infettata è qua, una è qui, un'altra è qua. Un'altra situazione è questa, metto una caterva di virus ad infettare e tutte le cellule o la grande maggioranza vengono infettate. (...) cosa devo fare per distinguere le colonie? Devo (…)
Perché devo usare necessariamente un terreno semisolido? Se io qui ci metto del terreno liquido, questa è la prima cellula infettata è circondata da tante cellule sorelle, una volta che ho infettato (nel terreno liquido) metto ad incubare, si ottiene una progenie che deriva dalla prima cellula infettata, questa cellula muore produce una progenie virale che va ad infettare questa, questa, questa. Il terreno è liquido, questa cellula produce una progenie che potrà liberarsi nel terreno liquido e andare ad infettare una cellula che è qui, una cellula che è qui, una che è qui. Si ripete, i virus... erano pochi, i virus che fuoriescono dalla rottura di una cellula infettata si muovono nel terreno liquido e praticamente tutte le cellule verranno esposte all'infezione. Qual è il risultato dopo 2 o 3 giorni? Il monostrato è tutto distrutto, non sono riuscita a contarli. Quand'è che riuscirò a contare? Riuscirò a contare quando qui avrò utilizzato un terreno semisolido. Tornando al nostro esempio, questo è l'unica cellula infettata, produce una progenie, siccome il terreno è solido, non può andare ad infettare cellule lontane, ad essere infettate saranno le cellule circostanti. Il processo si ripete man mano che i cicli di replicazione vanno avanti e va ad interessare altre cellule nelle vicinanze.
Questo è il risultato finale: una zona di lisi circondata da cellule sane. Perché abbiamo potuto circoscrivere questa zona? Perché c'era agar, agarosio o carbossido di cellulosa. Completa distruzione, qui ce ne sono veramente tanti; fino a quando arrivo a una diluizione 1 a 1000 e conto 40 placche. Le conto belle e isolate e ne conto 60, quanto sarà il titolo qua? 6 x 104. Questa è una titolazione che mi permette di risalire alle unità formanti placca non numero reale di virus. Perché io qui ovviamente avrò seminato anche virus defettivi, ma non si sono ovviamente replicati e non hanno dato origine a placche. È una modalità che ricorrendo a un terreno semisolido, mi consente di quantificare il numero di particelle virali complete e infettanti presenti in una titolazione. Prendo una coltura in laboratorio, la infetto con poliovirus, avvenuti i cicli di replicazione, raccolgo il tutto, elimino i detriti cellulari e avrò un terreno liquido che contiene la progenie di poliovirus. Quanti poliovirus ho ottenuto preparando questo stock? Faccio una serie di diluizioni, ho a disposizione di tutta una serie di piastrine di colture in cellule, una serie di diluizioni, faccio l'infezione, aggiungo un terreno semisolido, e poi sceglierò le piastre con un numero significativo di placche (2-3 non è un numero significativo, almeno una 50ina o un centinaio di placche), conto le placche.