Inibizione enzimatica incompetitiva
Nell'inibizione incompetitiva, l'inibitore si lega direttamente al complesso enzima-substrato, ma non all'enzima libero: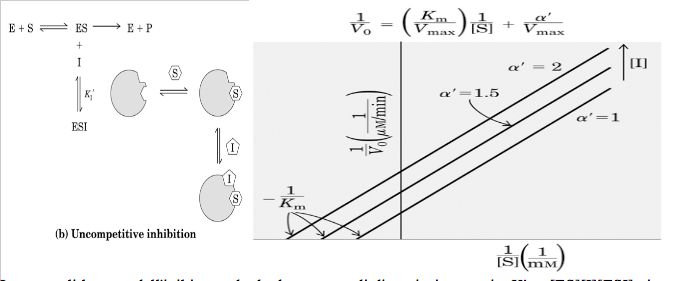
La tappa di legame dell'inibitore, che ha la costante di dissociazione pari a K'I = [ES][I][ESI] viene considerata all'equilibrio. Il legame dell'inibitore incompetitivo, che non necessariamente deve essere simile al substrato, può causare una distorsione strutturale del sito attivo, rendendo l'enzima cataliticamente inattivo. Il legame di I ad E non ha effetto, bisogna ricordare, sul legame di S ad E: S ed I si legano a due siti differenti sull'enzima. L'equazione di Michaelis-Menten per l'inibizione incompetitiva è:
v0 = Vmax[S]/KM+α'[S]
dove: α' = 1+[I]/K'I
Analizzando questa equazione, si può osservare che ad alti valori di [S], v0 si avvicina asintoticamente a Vmax/α' e quindi, al contrario di quanto accade nell'inibizione competitiva, gli effetti dell'inibizione incompetitiva sulla Vmax non sono annullati da un aumento della concentrazione del substrato. A bassa concentrazione del substrato, quando [S]<<KM, l'effetto di un inibitore incompetitivo diventa trascurabile; ancora una volta il comportamento è l'opposto di quello osservato nell'inibizione competitiva. Quando quest'ultima equazione viene trasformata nella forma di doppio reciproco abbiamo:
1/v0 = (KM/Vmax) 1/[S] + α'/Vmax
Il grafico dei doppi reciproci per l'inibizione incompetitiva produce una linea retta, con una pendenza pari a KM/Vmax (come nella reazione non inibita) e con le intercette sugli assi 1/v0 e 1/[S] corrispondenti rispettivamente a α'/Vmax e -α'/KM. Effettuando una serie di questi grafici a concentrazione di inibitore competitivo diverse si otterrà un gruppo li linee parallele (vedi grafico sopra). Questa caratteristica consente di identificare l'inibizione incompetitiva.
Continua a leggere:
- Successivo: Inibizione mista
- Precedente: Inibizione enzimatica competitiva
Dettagli appunto:
- Autore: Domenico Azarnia Tehran
- Università: Università degli Studi di Roma La Sapienza
- Facoltà: Scienze Matematiche, Fisiche e Naturali
- Corso: Scienze Biologiche
- Esame: Chimica biologica
- Titolo del libro: Biochimica
- Autore del libro: Donald Voet e Judith G. Voet
- Editore: Zanichelli
- Anno pubblicazione: 1993
Altri appunti correlati:
- Fisiologia della nutrizione
- Biologia molecolare
- Biochimica
- Struttura molecolare delle proteine
- Scienze e tecniche dietetiche applicate
Per approfondire questo argomento, consulta le Tesi:
- Crescita di Chlorella vulgaris in acque reflue da vinificazione: studio della cinetica di crescita e del contenuto in lipidi
- Evidenze nutrizionali per il recupero muscolare nell'atleta di endurance
- The role of CARMA2/CARD14 in NF-kB activation signalling
- Caratterizzazione delle specie ittiche di basso valore commerciale del Golfo di Manfredonia
- Approcci Sistemici e Transdisciplinari per la Gestione a lungo termine del Sovrappeso e dell’Obesità
Puoi scaricare gratuitamente questo riassunto in versione integrale.

