Complessi Fe-S
Complessi sopramolecolari: aggregati lipoproteici sulle membrane interne delle cellule procariote, nei batteri sull’unica membrana (esterna).
- COMPLESSO I: accetta NADH e CoQ come coenzimi reduttasici, contiene FMN come coenzima e strutture Fe-S, è costituito da 34 o più subunità.
- COMPLESSO II: accetta il succinato e CoQ, contiene FAD e struttture Fe-S, è costituito da 4 subunità
- COMPLESSO III: contiene il protoemo modificato e strutture Fe-S, è costituito da 10 subunità.
I complessi Fe-S sono costituiti da proteine in cui particolari intorni chelano Fe.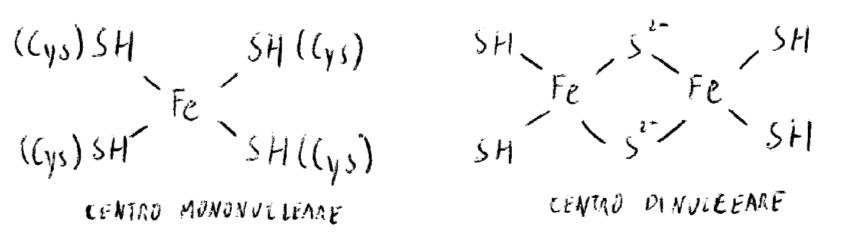
Il complesso I è trans-membrana, la struttura Fe –S riconosce NADH e lo lega promuovendone l’ossidazione attraverso FMN, he trasporta le unità riducenti. CoQ si aggancia alla proteina trans-membrana, e le unità riducenti si spostano da una lipoproteina all’altra.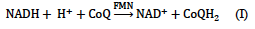
CoQ prende le unità riducenti del complesso I e le dà al complesso III (navetta del trasporto delle unità riducenti). Sul complesso III reagisce con i citocromi e per ogni eq di unità riducente, viene prodotto 1 eq di H+. Vengono quindi coinvolti i centri Fe-S. A fare da navetta è la proteina del citocromo c, una lipoproteina che occupa solo una metà del doppio strato fosfolipidico, che muove le unità riducenti dal complesso III al IV (trans-membrana).
CoQH2 + 2 Cyt c Fe3+→ CoQ + 2 Cyt c Fe++2 H+ (I→III)
Il complesso III ha i citocromi b e c, con c libero per fare da trasporto. Il complesso IV ha il citocromo a e contiene anche il Cu in un cluster istidina/cistina, e si muove verso l’accettore finale (O2 per gli aerobi, S per i batteri).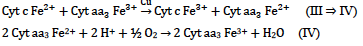
Vengono messi in libertà degli H+, che si incanalano in un sistema di trasporto (pompa protonica). La saturazione con H+ di alcuni siti interrompe l’interazione stabilizzante per coppia ionica, e l’assestamento genera un nuovo assetto conformazionale rendendo accessibile l’altro lato della membrana per il rilascio di H+. Il trasporto di H+ verso l’esterno crea una differenza di potenziale sui due lati della membrana, utilizzata per la sintesi di composti ad alta energia.
Cu è legato in un cluster istidina/cisteina in maniera equatoriale. Può esserci coinvolgimento, attraverso S e N che fanno da ligandi, del metallo nel trasporto di unità riducenti.
Continua a leggere:
- Successivo: Cicli di riduzione per l’accettore finale
- Precedente: Sistema della catena respiratoria
Dettagli appunto:
-
Autore:
Marco Lazzara
[Visita la sua tesi: "Determinazione di arsenico mediante voltammetria di stripping anodico con elettrodo in oro"]
[Visita la sua tesi: "I laser a coloranti: fondamenti e stato dell'arte"]
- Università: Università degli Studi di Torino
- Facoltà: Scienze Matematiche, Fisiche e Naturali
- Corso: Chimica
- Esame: Biochimica
- Docente: Carlo Giunta
Altri appunti correlati:
- Biochimica
- Fondamenti di chimica
- Appunti di Biochimica
- Catecolamine e glucagone
- Chimica Analitica Strumentale (Spettroscopia)
Per approfondire questo argomento, consulta le Tesi:
- Analisi dei nitriti attraverso il loro impiego nell’industria alimentare e applicazione di un’indagine percettiva sui consumatori
- Meccanismi biochimici ed effetti sulla salute umana del licopene
- Studio dei processi di degrado su manufatti archeologici in ambiente marino sommerso e sperimentazione di procedure innovative per la conservazione in situ
- Bio-lubricant from the olive mill waste through a new biocatalyst immobilized on ZnFe2O4
- Rational Design and Synthesis of Novel Acadesine-Like Modulators of AMPK
Puoi scaricare gratuitamente questo appunto in versione integrale.

