Reazioni enzimatiche a due substrati
Reazioni enzimatiche a due substrati
Le reazioni enzimatiche che coinvolgono due substrati (A e B) e formano due prodotti (P e Q) rappresentano circa il 60% delle reazioni biochimiche conosciute:
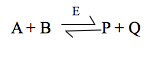
Quasi tutte queste reazioni chiamate a due substrati oppure bisubstrato sono reazioni di trasferimento, in cui l'enzima catalizza lo spostamento di un gruppo funzionale specifico X, da uno dei substrati all'altro:
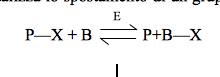
oppure reazioni di ossido riduzione, in cui vengono trasferiti equivalenti riducenti tra i due substrati.
Le reazioni di trasferimento di gruppo catalizzate da enzimi, comunque, possono essere suddivise in due grandi classi:
1. Reazioni sequenziali
Le reazioni in cui tutti i substrati si devono legare all'enzima prima che avvenga la trasformazione chimica e che i prodotti vengano rilasciati, sono chiamate reazioni sequenziali. Esse sono caratterizzate dal fatto che il gruppo che deve essere trasferito, X, viene spostato direttamente da A (=P—X) a B per formare P e Q (=B—X). Queste reazioni sono note anche come reazioni a singolo spostamento. Le reazioni sequenziali possono essere, inoltre, sottoclassificate sulla base dell'ordine di legame dei substrati all'enzima. Quelle che hanno un preciso ordine di ingresso dei substrati hanno un meccanismo ordinato, mentre quelle che non presentano nessuna preferenza per l'ordine di legame dei substrati, possiedono un meccanismo casuale. Nel meccanismo ordinato , il legame del primo substrato è apparentemente necessario per formare il sito di legame del secondo substrato, mentre nel meccanismo casuale, entrambi i siti di legame sono sempre presenti sull'enzima libero.
2. Reazioni a ping pong
I meccanismi con cui uno o più prodotti vengono rilasciati prima che tutti i substrati si siano legati all'enzima sono noti con il nome di meccanismi a ping pong. In questo caso il gruppo X del primo substrato A (=P—X) viene rimosso dal substrato da parte dell'enzima E e si forma il primo prodotto P e una forma enzimatica stabile F (= E—X) in cui X è saldamente legato (spesso covalentemente) all'enzima (fase ping). Nella seconda parte della reazione, X viene di nuovo spostato dall'enzima al secondo substrato B per formare il secondo prodotto Q (= B—X), rigenerando conseguentemente la forma originale dell'enzima E (fase pong). Queste reazioni sono pure chiamate reazioni a doppio spostamento (notare che in queste reazioni, i substrati A e B non si incontrano mai sulla superficie dell'enzima). Molti enzimi, come la chimotripsina, la transaminasi e alcune flavoproteine, reagiscono secondo questi meccanismi a ping pong.
SCAMBIO ISOTIPICO
I meccanismi a due substrati sequenziale (singolo spostamento) e a ping pong (doppio spostamento) possono essere differenziati anche mediante studi di scambi isotipici. Le reazioni di doppio spostamento sono in grado di scambiare un isotopo dal primo prodotto P indietro al primo substrato A, in assenza del secondo substrato. Consideriamo una reazione complessiva a ping pong catalizzata dall'enzima E a due substrati:
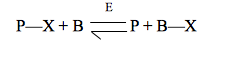
in cui, come al solito, A=P—X, Q=B—X e X è il gruppo che viene trasferito da un substrato all'altro nel corso della reazione. In assenza di B, può avvenire solo la prima parte della reazione. Se viene aggiunta alla miscela di reazione una piccola quantità di P marcato con un isotopo, indicato con P*, nella reazione inversa si formerà P*—X:
Direzione normale
E + P—X → E—X + P
Direzione inversa
E—X + P* → E + P*—X
cioè avverrà uno scambio isotipico. Al contrario, consideriamo ora la prima tappa di una reazione sequenziale. Qui si forma un complesso non covalente enzima substrato:
E + P—X → E . P—X
L'aggiunta di P* non determina uno scambio isotipico, in quanto durante la formazione di E . P—X non si ha la rottura di un legame covalente, cioè non si ha rilascio di P dall'enzima e quindi non si ha la possibilità di scambio isotipico con P*. La dimostrazione di uno scambio isotipico per un enzima a due substrati è, di conseguenza, una prova sperimentale convincente a favore di un meccanismo a ping pong.
Continua a leggere:
- Successivo: Meccanismi catalitici degli enzimi
- Precedente: Inibizione mista
Dettagli appunto:
- Autore: Domenico Azarnia Tehran
- Università: Università degli Studi di Roma La Sapienza
- Facoltà: Scienze Matematiche, Fisiche e Naturali
- Corso: Scienze Biologiche
- Esame: Chimica biologica
- Titolo del libro: Biochimica
- Autore del libro: Donald Voet e Judith G. Voet
- Editore: Zanichelli
- Anno pubblicazione: 1993
Altri appunti correlati:
- Fisiologia della nutrizione
- Biologia molecolare
- Biochimica
- Struttura molecolare delle proteine
- Scienze e tecniche dietetiche applicate
Per approfondire questo argomento, consulta le Tesi:
- Crescita di Chlorella vulgaris in acque reflue da vinificazione: studio della cinetica di crescita e del contenuto in lipidi
- Evidenze nutrizionali per il recupero muscolare nell'atleta di endurance
- The role of CARMA2/CARD14 in NF-kB activation signalling
- Caratterizzazione delle specie ittiche di basso valore commerciale del Golfo di Manfredonia
- Approcci Sistemici e Transdisciplinari per la Gestione a lungo termine del Sovrappeso e dell’Obesità
Puoi scaricare gratuitamente questo riassunto in versione integrale.

