Trasporto dell'anidride carbonica ed effetto Bohr
Oltre ad essere un trasportatore di ossigeno, l'Hb gioca un ruolo importante nel trasporto della CO2 da parte del sangue. Quando l'Hb, ma non la mioglobina, lega l'ossigeno ad un pH fisiologico, subisce una modificazione conformazionale che la rende un acido leggermente più forte. In seguito al legame dell'ossigeno si ha quindi il rilascio di un protone:
Hb(O2)nHx+O2 <--> Hb(O2)n+1+xH+
dove n può essere 1, 2, oppure 3 e x corrisponde a circa 0,6 in condizioni fisiologiche. Di conseguenza, aumentando il pH, cioè rimuovendo il protone, si stimola il legame dell'ossigeno all'emoglobina. Questo fenomeno è noto come effetto Bohr. Le circa 0,8 molecole di CO2 formate per ogni molecola di O2 consumata durante la respirazione diffondono dal tessuto verso i capillari, in gran parte sotto forma di CO2 disciolta in acqua a causa della lentezza della reazione di formazione del bicarbonato:
CO2+H2O <--> H++HCO3-
Questa reazione viene catalizzata negli eritrociti dall'anidrasi carbonica. Quindi la maggior parte della CO2 nel sangue viene trasportata in forma di bicarbonato. Nei capillari dove la pO2 è bassa, il protone generato dalla formazione del bicarbonato viene assunto dall'emoglobina, che viene indotta a rilasciare l'ossigeno che ha legato. Questa assunzione di H+ facilita inoltre il trasporto della CO2 stimolando la formazione del bicarbonato. Al contrario nei polmoni, dove la pO2 è elevata, il legame dell'ossigeno all'Hb determina il rilascio del protone implicato nell'effetto Bohr, che a sua volta sposta verso sinistra l'equilibrio della CO2. Queste reazioni sono molto correlate e quindi causano piccole variazioni del pH del sangue. Quindi aumentando il pH si stimola il legame dell'ossigeno all'emoglobina; diminuendolo, invece, è favorita la dissociazione dell'O2 dall'emoglobina.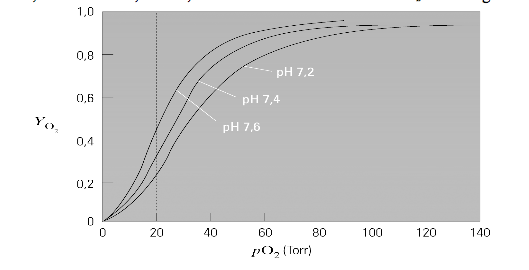
Un'altra parte della CO2 si combina reversibilmente con i gruppi ammino-terminali delle proteine del sangue formando carbammati:
R—NH2+CO2 <--> R—NH—COO-+H+
La conformazione dell Hb deossigenata (deossiHb), come vedremo, è significativamente diversa da quella dell'Hb ossigenata (ossiHb). Di conseguenza la deossiHb lega più CO2 sotto forma di carbammato della ossiHb. La CO2, come il protone, è quindi un modulatore dell'affinità dell'Hb per l'ossigeno. Una concentrazione elevata di CO2, situazione presente nei capillari, stimola l'emoglobina a rilasciare ossigeno che ha legato a sé. È giusto notare che i protoni rilasciati durante la formazione del carbammato vengono, in parte, assunti dall'emoglobina mediante l'effetto Bohr ed aumentano la quantità di ossigeno che si stacca dalla proteina.
Continua a leggere:
- Successivo: Effetto del BPG sul legame dell'ossigeno
- Precedente: Legame dell'ossigeno
Dettagli appunto:
- Autore: Domenico Azarnia Tehran
- Università: Università degli Studi di Roma La Sapienza
- Facoltà: Scienze Matematiche, Fisiche e Naturali
- Corso: Scienze Biologiche
- Esame: Chimica biologica
- Titolo del libro: Biochimica
- Autore del libro: Donald Voet e Judith G. Voet
- Editore: Zanichelli
- Anno pubblicazione: 1993
Altri appunti correlati:
- Fisiologia della nutrizione
- Biologia molecolare
- Biochimica
- Struttura molecolare delle proteine
- Scienze e tecniche dietetiche applicate
Per approfondire questo argomento, consulta le Tesi:
- Crescita di Chlorella vulgaris in acque reflue da vinificazione: studio della cinetica di crescita e del contenuto in lipidi
- Evidenze nutrizionali per il recupero muscolare nell'atleta di endurance
- The role of CARMA2/CARD14 in NF-kB activation signalling
- Caratterizzazione delle specie ittiche di basso valore commerciale del Golfo di Manfredonia
- Approcci Sistemici e Transdisciplinari per la Gestione a lungo termine del Sovrappeso e dell’Obesità
Puoi scaricare gratuitamente questo riassunto in versione integrale.

